什么是kNH3=1.76?
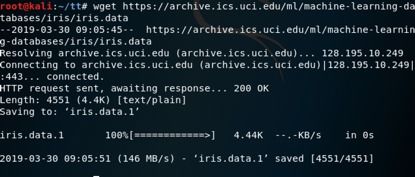
kNH3=1.76是一个化学平衡常数,用于描述氨(NH3)在水溶液中的溶解平衡。这个常数表示在一定温度下,氨气与氨水之间的平衡状态。在化学中,平衡常数是衡量化学反应达到平衡状态时反应物和生成物浓度比值的常数。对于氨的溶解平衡,可以表示为:
NH3(g)?NH3(aq)
其中,NH3(g)代表气态氨,NH3(aq)代表水溶液中的氨。kNH3=1.76表示在特定温度下,气态氨与水溶液中氨的浓度比值恒定为1.76。
平衡常数的意义
平衡常数是化学反应平衡状态的重要指标,它可以帮助我们了解反应物和生成物在平衡状态下的浓度关系。在氨的溶解平衡中,kNH3=1.76的意义如下:
1.反应方向:当kNH3>1时,表示生成物的浓度大于反应物的浓度,反应倾向于生成物方向进行。在本例中,kNH3=1.76,说明氨气在水中的溶解度较高,反应倾向于生成氨水。
2.浓度关系:通过平衡常数,我们可以计算出反应物和生成物在平衡状态下的浓度。例如,如果已知氨气的浓度为0.1mol/L,那么氨水的浓度可以通过以下公式计算:
[NH3(aq)]=kNH3×[NH3(g)]
[NH3(aq)]=1.76×0.1mol/L=0.176mol/L
3.温度影响:平衡常数是温度的函数,随着温度的变化,平衡常数也会发生变化。根据勒夏特列原理,当温度升高时,平衡常数会减小,反应方向会向吸热方向移动;当温度降低时,平衡常数会增大,反应方向会向放热方向移动。
氨的溶解平衡应用

1.氨水制备:通过调节氨气的压力和温度,可以控制氨水的浓度,从而制备不同浓度的氨水。
2.氨肥生产:氨是氮肥的主要成分,通过控制氨的溶解平衡,可以优化氮肥的生产过程。
3.氨气吸收:在工业生产中,氨气是一种常见的污染物,通过氨的溶解平衡,可以有效地吸收氨气,减少对环境的影响。
4.氨水应用:氨水在农业、化工、医药等领域有广泛的应用,如作为消毒剂、清洁剂、制冷剂等。
实验测定kNH3=1.76的方法
要测定氨的溶解平衡常数kNH3=1.76,可以采用以下实验方法:
1.准备一定浓度的氨水溶液,并测量其pH值。
2.在氨水溶液中滴加一定量的酸或碱,使溶液中的氨与酸或碱反应,生成相应的盐和水。
3.通过测量反应前后溶液的pH值变化,可以计算出氨的浓度变化。
4.根据氨的浓度变化,可以计算出氨的溶解平衡常数kNH3。
实验过程中,需要注意以下几点:
-实验温度应保持恒定,以确保平衡常数的准确性。
-实验过程中要避免氨的挥发,以免影响实验结果。
-实验数据应多次测量,取平均值,以提高实验结果的可靠性。
kNH3=1.76是氨的溶解平衡常数,它反映了氨气与氨水之间的平衡状态。通过了解平衡常数的意义和应用,我们可以更好地掌握氨的溶解平衡,并在实际生产生活中发挥其重要作用。同时,通过实验测定平衡常数,可以加深对化学平衡理论的理解,提高化学实验技能。
